
看似簡單的疏水效應與去溶劑化,我們到底懂了多少?
大家應該都知道疏水效應(hydrophobic effect),即水溶液中非極性分子折疊或締合的現象,說人話就是,油與水不互溶。
疏水效應說起來很簡單直觀,但它卻是個狠角色!比如,在蛋白折疊、藥物-蛋白相互作用,及蛋白-蛋白相互作用中,疏水效應常常是決定性因素之一呢[1]!
說到疏水性在藥物-蛋白相互作用中的重要影響,事實上大部分上市的小分子藥物都有一定的疏水性[2]。實驗也表明,疏水相互作用對結合的貢獻是十分巨大的,可以達到約30 cal / (mol· ?)。這是什么概念呢?比如,添加一個甲基(-CH3)產生的疏水相互作用,對結合自由能的貢獻是0.7kcal/mol,或者說可以提升3.5倍左右的活性[1]!
疏水相互作用如此普遍又如此重要,你會不會很好奇,它的本質到底是什么?嗯,我們就是欣賞這種求索的精神!今天,小編就和大伙兒深扒一下疏水相互作用,并且還會聊到二號主角:去溶劑化(Desolvation)。
說到氫鍵或者離子鍵的本質,可以理解為電子云一定程度的分布交疊或者靜電相互作用。但是,疏水相互作用卻無法從原子間的力來理解,比如你很難解釋苯環上的一個碳原子究竟是通過什么原子間作用力勾搭上甲基的碳原子,形成疏水相互作用的。
那么,驅動疏水相互作用的到底是何方神圣呢?
說出來,其實一點也不神秘,它就是“熵”(Entropic)[3]!我們知道在恒溫恒壓體系下可以用吉布斯自由能(Gibbs Free Energy)判斷熱力學過程是否自發,其方程如下:
ΔG=ΔH?TΔS
這個方程也來描述溶質的溶解過程,當ΔG<0代表溶解過程自發,反之則不是。方程式中ΔH指焓變,ΔS指的是熵變。
其實這個方程也可以用來描述藥物分子和蛋白的相互作用過程:任何的藥物結合過程其實都是焓變和熵變的共同結果,只是我們在理解結合過程時往往忽略了熵變的作用。
熵,是啥玩意兒呢?官方定義,熵是體系下所有微觀狀態數的總和的自然對數值乘以玻爾茲曼常數。對這個定義看不懂也沒關系,我們只需要知道,從自由能的角度,如果某種變化使得體系有更多的狀態數,則有利于這種變化的自發。
回到我們的疏水作用上,如果我們將疏水性的溶質丟進水中,那自由能如何變化呢?首先水中本來的氫鍵網絡將會被破壞以騰出空間給疏水性溶質,這是一個吸熱過程。緊接著,在疏水性溶質周圍,水分子將會形成一個類似牢籠的結構,形成更加有序的氫鍵。
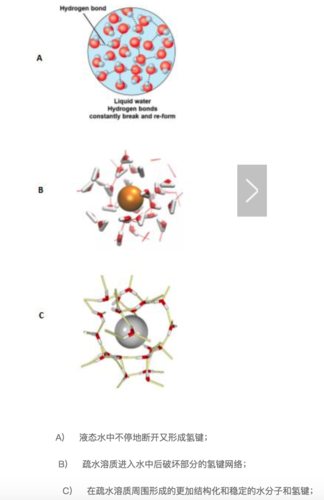
我們細想一下會發現,整個過程中的焓變(ΔH)很難說是正、負或者不變的,因為新形成的氫鍵或許能補償第一步打斷的氫鍵的能量。但是,疏水性溶質周圍更加有序(結構化)的水分子將使得體系的熵變(ΔS)減小,并且這個變化往往比焓變的變化更大。根據吉布斯自由能公式,ΔG=ΔH?TΔS,較小的ΔH(正負未知)減去一個負的較大的ΔS,這個結果是正的,代表著疏水性溶質無法自發的溶解到水中。當疏水性溶質聚集時,這個聚集的整體與水的接觸表面比溶質完全均勻分散在溶液中的接觸表面小,有序化的水分子降到最少,自由的、有更多狀態數的水分子達到最多,同時熵也最大,這就是疏水效應。
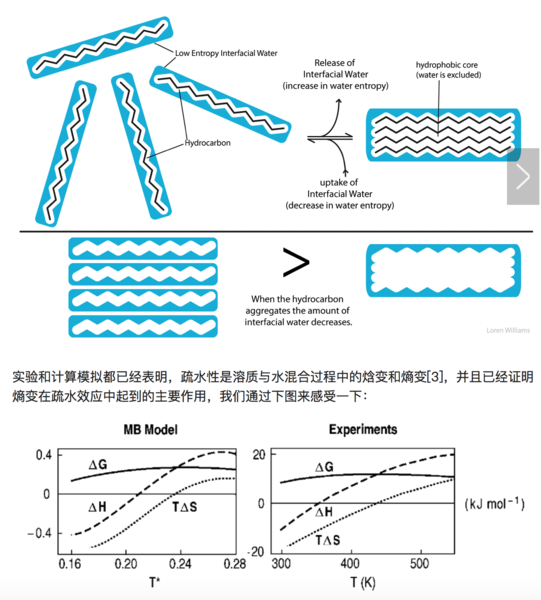
上圖表示不同溫度下溶質溶解的焓變、熵變和吉布斯自由能變化。橫軸代表不同溫度。左圖是LJ溶質溶解到MB水溶液中的理論預測結果,右圖是疏水溶質溶解的實驗結果。橫軸代表溫度,可以看到不同溫度下疏水性溶質的溶解吉布斯自由能都是正的,也就是說,不能自發溶解。
回到小分子藥物與蛋白相互作用體系上,現在有人問你,為什么加入疏水性基因可以提高藥物分子的活性呢?領悟了如上所述的攻略,你是不是很輕松地就能找到答案:因為疏水性基團進入疏水性的蛋白口袋,使得整體的疏水性基團盡量少的暴露在水溶液中,于是就使體系更加穩定從而提升活性。這個回答可以給滿分吧?^_^
但是呢,還沒完,如果我告訴你,疏水基團與親水基團的替換,甚至可以讓活性變化4萬倍,你會不會覺得難以置信?
來,不急,我們繼續聊~ 故事還是得從疏水效應說起:在某些體系中,疏水性蛋白表面用一些合適的疏水性原子占據,我們發現,這對結合自由能的貢獻可以達到幾個kcal/mol [4]!比如下面這個例子:
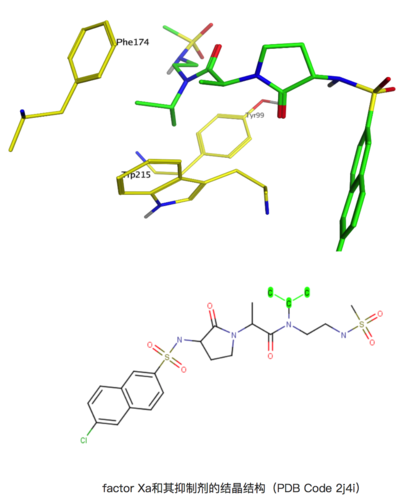
factor Xa和其抑制劑的結晶結構(PDB Code 2j4i)
上圖是factor Xa和其抑制劑(From GSK)的結晶結構(PDB Code 2j4i),其Ki是1nM,但是如果將圖示中高亮出的異丙基替換成氫(H),其活性直接下降到39μM,活性直接相差了4萬倍!
上圖例子中可以看到,Tyr99、Trp215和Phe174組成的疏水性的結合空腔,通過配體上的異丙基形成疏水相互作用,從而提高活性。但是這一次,不提則已,一提就是驚人的4萬倍!這是為什么呢?
要說清楚這個問題,就得請出今天的二號主角,也是大家在藥物設計中容易忽略的,去溶劑化效應(desolvation)。
如下圖清晰的描述了該過程,藥物分子在水溶液環境里進入靶標蛋白結合空腔的過程中,需要脫離原來的水環境,并且將靶標結合口袋中的水排出,這個過程中耗散或獲得的能量就是去溶劑化能。
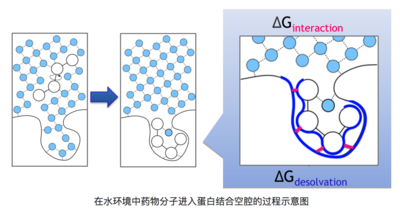
在水環境中藥物分子進入蛋白結合空腔的過程示意圖
回到factor Xa的例子,我們在3D結構中看一下結合口袋的位置(下圖),很明顯,結合口袋并未深入蛋白質內部,而是在靠近溶劑可及的表面。假設沒有疏水性的異丙基占據,疏水性空腔位置可能占據著一些水分子,同樣這些在疏水表面的水分子會更加的有序其狀態數會較少,從而對結合自由能有不利的貢獻;而通過異丙基能夠幫助排出這些水分子,從而獲得除了疏水相互作用外的一部分能量,所以活性被大大提升了[5,6]。從這個例子中我們可以看到,藥物設計中我們還需要考慮在無配體結合狀態下結合口袋可能的水化狀態!
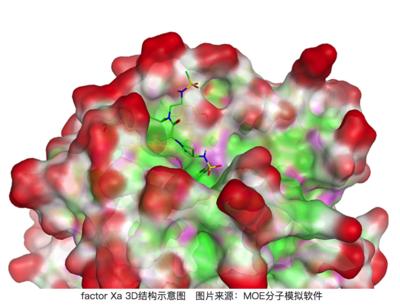
上圖可以看到2j4i中的配體結合口袋在靠近蛋白表面,處于溶劑容易進入的區域。紅色區域代表暴露溶劑中的區域,青色代表疏水區域,粉色代表極性基團區域。
值得注意的是,去溶劑化也有可能會導致看起來能夠很好地與受體結合的分子其實并不能很好地結合。比如在一個針對HIV-1蛋白酶抑制劑耐藥性的研究中發現,因為突變導致結合口袋的去溶劑化能顯著提高,從而導致了耐藥性[7]。
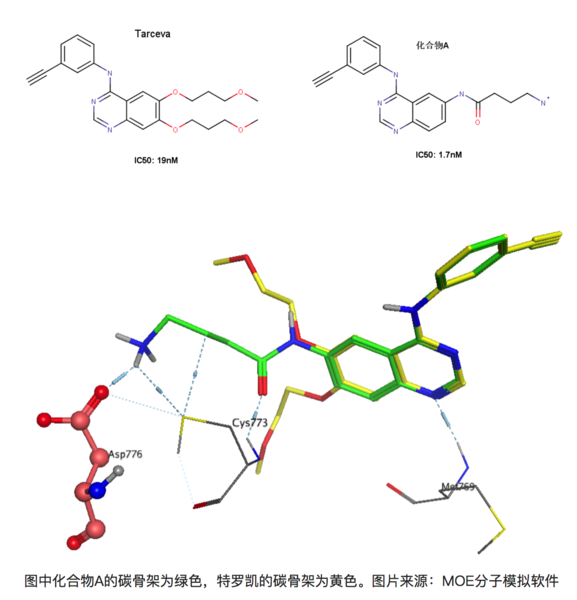
再比如在有喹唑啉母環的化合物是一類重要的EGFR(epidermal growth factor receptor,表皮生成因子受體)抑制劑,易瑞沙和特羅凱都屬于該類藥物。比如下圖的兩個化合物,左圖為著名藥物特羅凱,右圖為發現的另外一個同系的EGFR抑制劑(暫且稱為化合物A)[8]。右圖化合物A能與EGFR 的Asp776形成離子鍵,大家知道離子鍵能達到的鍵能是極強的,理論上,與特羅凱相比,化合物A的活性提升應該遠不止10倍。
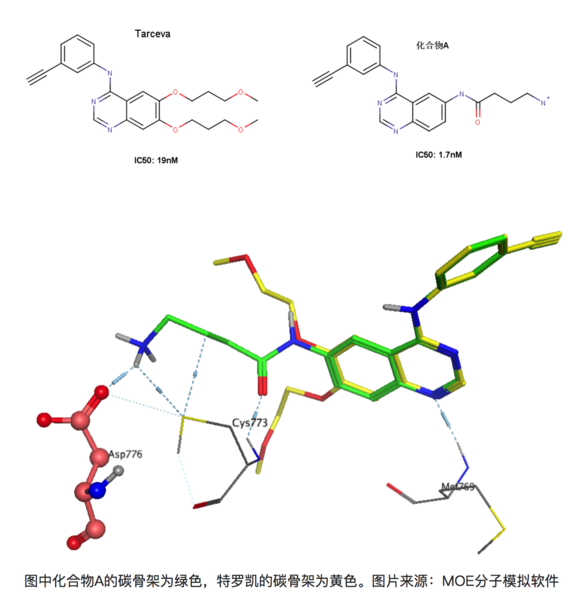
上圖為化合物A和特羅凱的疊合結果,可以看到化合物A能和Asp776形成鍵能較強的離子鍵,但是活性卻只提升了10倍!其實這正是由于去溶劑化能的影響,Asp776位于溶劑可及的蛋白表面上,容易與水形成較為穩定的氫鍵,因此要與-NH3+作用時必須脫離與某些水分子的作用而耗費一定的能量。同理,化合物A上的-NH3+也是一樣的,需要斷開一部分與水形成的氫鍵在于Asp776的羧基相互作用。因此看似形成很強的氫鍵,但是由于去溶劑化的作用,其活性的提升未必有想象中的理想。


隨著電子產品防水需求的不斷提高,從原先的 IP54到現在的IP67IP68等級!市場上出現了防水透氣膜和防水透音膜,目前這兩種不同的材料應用被搞混了,今天便與大家一起討論防水透氣
最近各地降雨量激增,所以手機就難免會沾點水,作為生活中不可或缺的電子產品,防水已經成為一個十分重要重要功能,而且個人對目前的IP68手機市場是相當不滿意的。為什么?太貴
自然界中荷葉具有出淤泥而不染的典型不沾水特性(學術上稱為Cassie-Baxter狀態),具有自清潔、抗結冰、減阻、抗腐蝕等廣泛應用價值,而玫瑰花瓣則具有水滴高粘附特性(稱為Wenze

派瑞林各種粉材真空鍍膜技術加工 納米涂層防水處理
派瑞林各種粉材真空鍍膜技術加工 納米涂層防水處理

高阻隔強絕緣防汗液涂層藍牙耳機3C電子產品IPX7納米材料
高阻隔強絕緣防汗液涂層藍牙耳機3C電子產品IPX7納米材料

耐磨超疏水納米材料 絕緣子架空導線電纜橋梁防覆冰涂層
耐磨超疏水納米材料 絕緣子架空導線電纜橋梁防覆冰涂層

真空等離子氣相沉積技術納米防水鍍膜加工 產能5萬片天
真空等離子氣相沉積技術納米防水鍍膜加工 產能5萬片天
親水疏油自潔凈納米涂層 易去污 無機防紫外高硬度材料
親水疏油自潔凈納米涂層 易去污 無機防紫外高硬度材料

臺灣超親水防霧塑料專用 附著力好 透過率高 持久有效
臺灣超親水防霧塑料專用 附著力好 透過率高 持久有效

