
生物相容性有哪些測試項目?
為了提高醫學診療技術的有效性,許多微型和超微型醫療裝置采用體內植入、導管插入和膠囊吞入等方法,例如植入式心臟起搏器與除顫器、植入式人工耳蝸、植入式人工括約肌、植入式生物電控制假肢,植入式心臟輔助泵、吞服式無線電膠囊、各類導管技術和各類人工器官與生物材料等。植入式診療系統由于埋植在人體內部,其外殼封裝材料和一些傳感器、動作裝置等均直接與組織、血液等直接接觸,有些需長期留置體內,這些植入式材料表面將 與組織、血液、細胞間產生相互作用,并產生不同的(物理的、化學的、生物的)反應。生物相容性(Biocampatibility,BC)是指生物材料(含傳感器與動作裝置)與生物體內的組織和血液中的生化成份相容,材料不被腐蝕且對生物體不產生毒副作用的特性與能力。
生物相容性通常包括組織相容性與血液相容性兩大類:組織相容性涵蓋細胞吸附性、無抑制細胞生長性、細胞激活性、抗細胞原生質轉化性、抗類癥性、無抗原性、無誘變性、無致癌性、無致畸性等;血液相容性是指能抗血小板血栓形成、抗凝血性、抗溶血性、抗白血細胞減少性、抗補體系統亢進性、抗血漿蛋白吸附性和抗細胞因子吸附性等。目前用于體內植入裝置的生物醫用材料包括硅橡膠、環氧樹脂、聚乙稀、聚合脂等各種高分子材料,鉑、鈦、鉭、不銹鋼等各種金屬材料,長期植入裝置還需選用耐腐蝕的貴金屬,例如鈦合金、鉑合金、鈷合金等作為封裝材料,這些材料除有較高的生物相容性外,還具有較高的穩定性、密封性、形變小、機械強度高等優點。
生物醫用材料及其制作與封裝的體內植入式器械的生物相容性和相關質量直接關系到患者的生命安全,應該通過嚴格的生物學評估(biological evaluation),并實行國家統一的注冊審批制度,以確保安全。生物學評估可按接觸部位(皮膚、粘膜、組織、血液等)、接觸方式(直接或間接)、接觸時間(暫時、中期和長期)和用途分類,評估的生物學實驗項目包括細胞毒性試驗、致敏試驗、刺激反應試驗、亞急性毒性試驗、植入試驗、血液相容性試驗、慢性毒性試驗、致癌性試驗、生殖與發育毒性試驗、生物降解試驗等。
|
項目名稱 |
檢測依據 |
|
PH測定 |
醫用注射化學分析方法:第1部分 GB 14233.1-1998 |
|
還原物質測定 |
醫用注射化學分析方法:第1部分 GB 14233.1-1998 |
|
重金屬測定 |
醫用注射化學分析方法:第1部分 GB 14233.1-1998 |
|
EO(Eto、Etc、Etg)殘留量 |
醫療器械生物學評價第7部分:環氧乙烷消毒殘留物 GB/T 16886.7-2003 ISO 10993-7:1995 |
|
真空泄漏試驗 |
ISO 11607:2006,ASTM F1980-02 |
|
封口剝離試驗 |
ASTM F88-06,ASTM F1980-02 |
|
顏料滲漏試驗 |
用染色滲透液檢測多孔醫療包裝封口密封性的標準試驗方法 ASTM F1929-1998,ASTM F1980-02 |
|
瓊脂攻擊試驗 |
ISO 11607:2006,ASTM F1980-02 |
|
加速老化試驗(二年) |
無菌醫療產品包裝的加速老化的標準指南 ASTM F1980-2002、ISO11737-2:1998 |
|
環境檢測 |
GB 15980-1995 |
|
皮膚刺激 |
醫療器械生物學評價第10部分:刺激與遲發型超敏反應試驗GB/T 16886.10-2005 ISO 10993-10:2002 2006增補 |
|
致敏試驗 |
醫療器械生物學評價第10部分:刺激與遲發型超敏反應試驗GB/T 16886.10-2005 ISO 10993-10:2002 2006增補 |
|
細胞毒性試驗 |
醫療器械生物學評價第5部分:體外細胞毒性試驗GB/T 16886.5-2003ISO 10993-5-1999 |
|
細胞毒性試驗 |
醫療器械生物學評價第5部分:體外細胞毒性試驗GB/T 16886.5-2003ISO 10993-5-1999 |
|
皮膚刺激 |
醫療器械生物學評價第10部分:刺激與遲發型超敏反應試驗GB/T 16886.10-2005 ISO 10993-10:2002 |
|
致敏試驗 |
醫療器械生物學評價第10部分:刺激與遲發型超敏反應試驗GB/T 16886.10-2005 ISO 10993-10:2002 |
|
抗拉強度 |
ISO 11607-2006 |
|
爆破試驗 |
ASTM-1140-00,ASTM F 1980-02 |
|
無菌試驗(樣品) |
醫療器械的滅菌微生物方法第2部分:無菌檢驗在滅菌確認過程中的應用ISO11737-2:1998 |
|
內毒素測定 |
USP29 |
|
黏膜刺激試驗 |
ISO 10993.10-2002/Amd.1:2006 |
|
熱原試驗(兔法) |
ISO 10993.10 |
|
殘留粉塵測定 |
醫用手套上殘留粉末的標準試驗方法ASTM D6124-2001 |
|
氯化物 |
醫用輸液、輸血、注射器具檢驗方法第1部分:化學分析方法GB/T 14233.1-1998 |
|
細胞毒性試驗 |
醫療器械生物學評價第5部分:體外細胞毒性試驗GB/T 16886.5-2003ISO 10993-5-1999 |
|
細菌總數 |
一次性使用醫療用品衛生標準ISO11138-1:2006 |
|
致敏試驗 |
醫療器械生物學評價第10部分:刺激與遲發型超敏反應試驗GB/T 16886.10-2005 ISO 10993-10:2002 2006增補 |
|
皮膚刺激 |
醫療器械生物學評價第10部分:刺激與遲發型超敏反應試驗GB/T 16886.10-2005 ISO 10993-10:2002 2006增補 |
|
急性毒性試驗 |
醫療器械生物學評價第11部分:全身毒性試驗GB/T 16886.11-1997 ISO 10993-11:1997 |
|
溶血試驗 |
醫療器械生物學評價第4部分:與血液相互作用試驗選擇GB/T 16886.4-2003 ISO 10993-4:2002 |
|
肌肉植入試驗 |
醫療器械生物學評價第6部分:植入后局部反應試驗GB/T 16886.6-1997 ISO 10993-6:1994 |
|
Ames試驗 |
醫療器械生物學評價第3部分:遺傳毒性、致癌性和生殖毒性試驗GB/T 16886.3-1997 ISO 10993-3:1992 |
|
微核試驗 |
醫療器械生物學評價第3部分:遺傳毒性、致癌性和生殖毒性試驗GB/T 16886.3-1997 ISO 10993-3:1992 |
|
染色體畸變試驗 |
醫療器械生物學評價第3部分:遺傳毒性、致癌性和生殖毒性試驗GB/T 16886.3-1997 ISO 10993-3:1992 |
|
熱源試驗 |
醫療器械生物學評價第11部分:全身毒性試驗GB/T 16886.11-1997 ISO 10993-11:1997 |
|
內毒素測定 |
一次性醫用手套第3部分:生物評定要求和試驗EN455-3-2000 |
|
初始污染菌檢測 |
醫療器械的滅菌微生物方法第1部分:產品微生物的評估 ISO11737-1:2006 |
|
無菌檢查(BI) |
醫療器械的滅菌微生物方法第2部分:無菌檢驗在滅菌確認過程中的應用ISO11138-1:2006、USP |
|
產品釋出物檢驗 |
醫療器械的滅菌微生物方法第1部分:產品微生物的評估 ISO11737-1:2006 |
|
微生物校正因子 |
醫療器械的滅菌微生物方法第1部分:產品微生物的評估 ISO11737-1:2006 |
|
輻射滅菌劑量設定 |
醫療保健產品滅菌確認和常規控制要求輻射滅菌 GB 18280-2000 ISO 11137:2006 |
|
蛋白質測定 |
使用經修改的洛雷法分析天然橡膠及其制品中含水可提取蛋白質的試驗方法
|

隨著電子產品防水需求的不斷提高,從原先的 IP54到現在的IP67IP68等級!市場上出現了防水透氣膜和防水透音膜,目前這兩種不同的材料應用被搞混了,今天便與大家一起討論防水透氣
最近各地降雨量激增,所以手機就難免會沾點水,作為生活中不可或缺的電子產品,防水已經成為一個十分重要重要功能,而且個人對目前的IP68手機市場是相當不滿意的。為什么?太貴
自然界中荷葉具有出淤泥而不染的典型不沾水特性(學術上稱為Cassie-Baxter狀態),具有自清潔、抗結冰、減阻、抗腐蝕等廣泛應用價值,而玫瑰花瓣則具有水滴高粘附特性(稱為Wenze

派瑞林各種粉材真空鍍膜技術加工 納米涂層防水處理
派瑞林各種粉材真空鍍膜技術加工 納米涂層防水處理

高阻隔強絕緣防汗液涂層藍牙耳機3C電子產品IPX7納米材料
高阻隔強絕緣防汗液涂層藍牙耳機3C電子產品IPX7納米材料

耐磨超疏水納米材料 絕緣子架空導線電纜橋梁防覆冰涂層
耐磨超疏水納米材料 絕緣子架空導線電纜橋梁防覆冰涂層

真空等離子氣相沉積技術納米防水鍍膜加工 產能5萬片天
真空等離子氣相沉積技術納米防水鍍膜加工 產能5萬片天
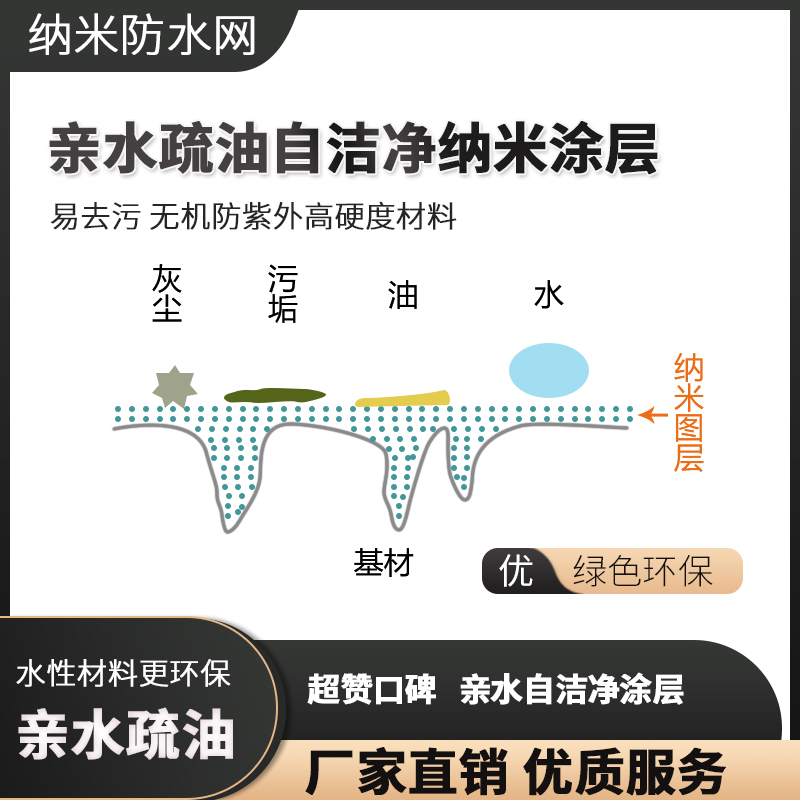
親水疏油自潔凈納米涂層 易去污 無機防紫外高硬度材料
親水疏油自潔凈納米涂層 易去污 無機防紫外高硬度材料

臺灣超親水防霧塑料專用 附著力好 透過率高 持久有效
臺灣超親水防霧塑料專用 附著力好 透過率高 持久有效

