
看似簡單的疏水效應(yīng)與去溶劑化,我們到底懂了多少?
大家應(yīng)該都知道疏水效應(yīng)(hydrophobic effect),即水溶液中非極性分子折疊或締合的現(xiàn)象,說人話就是,油與水不互溶。
疏水效應(yīng)說起來很簡單直觀,但它卻是個狠角色!比如,在蛋白折疊、藥物-蛋白相互作用,及蛋白-蛋白相互作用中,疏水效應(yīng)常常是決定性因素之一呢[1]!
說到疏水性在藥物-蛋白相互作用中的重要影響,事實上大部分上市的小分子藥物都有一定的疏水性[2]。實驗也表明,疏水相互作用對結(jié)合的貢獻是十分巨大的,可以達到約30 cal / (mol· ?)。這是什么概念呢?比如,添加一個甲基(-CH3)產(chǎn)生的疏水相互作用,對結(jié)合自由能的貢獻是0.7kcal/mol,或者說可以提升3.5倍左右的活性[1]!
疏水相互作用如此普遍又如此重要,你會不會很好奇,它的本質(zhì)到底是什么?嗯,我們就是欣賞這種求索的精神!今天,小編就和大伙兒深扒一下疏水相互作用,并且還會聊到二號主角:去溶劑化(Desolvation)。
說到氫鍵或者離子鍵的本質(zhì),可以理解為電子云一定程度的分布交疊或者靜電相互作用。但是,疏水相互作用卻無法從原子間的力來理解,比如你很難解釋苯環(huán)上的一個碳原子究竟是通過什么原子間作用力勾搭上甲基的碳原子,形成疏水相互作用的。
那么,驅(qū)動疏水相互作用的到底是何方神圣呢?
說出來,其實一點也不神秘,它就是“熵”(Entropic)[3]!我們知道在恒溫恒壓體系下可以用吉布斯自由能(Gibbs Free Energy)判斷熱力學(xué)過程是否自發(fā),其方程如下:
ΔG=ΔH?TΔS
這個方程也來描述溶質(zhì)的溶解過程,當(dāng)ΔG<0代表溶解過程自發(fā),反之則不是。方程式中ΔH指焓變,ΔS指的是熵變。
其實這個方程也可以用來描述藥物分子和蛋白的相互作用過程:任何的藥物結(jié)合過程其實都是焓變和熵變的共同結(jié)果,只是我們在理解結(jié)合過程時往往忽略了熵變的作用。
熵,是啥玩意兒呢?官方定義,熵是體系下所有微觀狀態(tài)數(shù)的總和的自然對數(shù)值乘以玻爾茲曼常數(shù)。對這個定義看不懂也沒關(guān)系,我們只需要知道,從自由能的角度,如果某種變化使得體系有更多的狀態(tài)數(shù),則有利于這種變化的自發(fā)。
回到我們的疏水作用上,如果我們將疏水性的溶質(zhì)丟進水中,那自由能如何變化呢?首先水中本來的氫鍵網(wǎng)絡(luò)將會被破壞以騰出空間給疏水性溶質(zhì),這是一個吸熱過程。緊接著,在疏水性溶質(zhì)周圍,水分子將會形成一個類似牢籠的結(jié)構(gòu),形成更加有序的氫鍵。

我們細想一下會發(fā)現(xiàn),整個過程中的焓變(ΔH)很難說是正、負(fù)或者不變的,因為新形成的氫鍵或許能補償?shù)谝徊酱驍嗟臍滏I的能量。但是,疏水性溶質(zhì)周圍更加有序(結(jié)構(gòu)化)的水分子將使得體系的熵變(ΔS)減小,并且這個變化往往比焓變的變化更大。根據(jù)吉布斯自由能公式,ΔG=ΔH?TΔS,較小的ΔH(正負(fù)未知)減去一個負(fù)的較大的ΔS,這個結(jié)果是正的,代表著疏水性溶質(zhì)無法自發(fā)的溶解到水中。當(dāng)疏水性溶質(zhì)聚集時,這個聚集的整體與水的接觸表面比溶質(zhì)完全均勻分散在溶液中的接觸表面小,有序化的水分子降到最少,自由的、有更多狀態(tài)數(shù)的水分子達到最多,同時熵也最大,這就是疏水效應(yīng)。
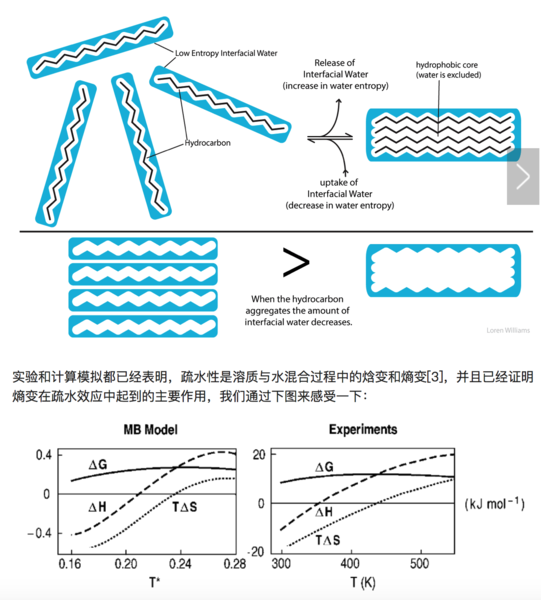
上圖表示不同溫度下溶質(zhì)溶解的焓變、熵變和吉布斯自由能變化。橫軸代表不同溫度。左圖是LJ溶質(zhì)溶解到MB水溶液中的理論預(yù)測結(jié)果,右圖是疏水溶質(zhì)溶解的實驗結(jié)果。橫軸代表溫度,可以看到不同溫度下疏水性溶質(zhì)的溶解吉布斯自由能都是正的,也就是說,不能自發(fā)溶解。
回到小分子藥物與蛋白相互作用體系上,現(xiàn)在有人問你,為什么加入疏水性基因可以提高藥物分子的活性呢?領(lǐng)悟了如上所述的攻略,你是不是很輕松地就能找到答案:因為疏水性基團進入疏水性的蛋白口袋,使得整體的疏水性基團盡量少的暴露在水溶液中,于是就使體系更加穩(wěn)定從而提升活性。這個回答可以給滿分吧?^_^
但是呢,還沒完,如果我告訴你,疏水基團與親水基團的替換,甚至可以讓活性變化4萬倍,你會不會覺得難以置信?
來,不急,我們繼續(xù)聊~ 故事還是得從疏水效應(yīng)說起:在某些體系中,疏水性蛋白表面用一些合適的疏水性原子占據(jù),我們發(fā)現(xiàn),這對結(jié)合自由能的貢獻可以達到幾個kcal/mol [4]!比如下面這個例子:
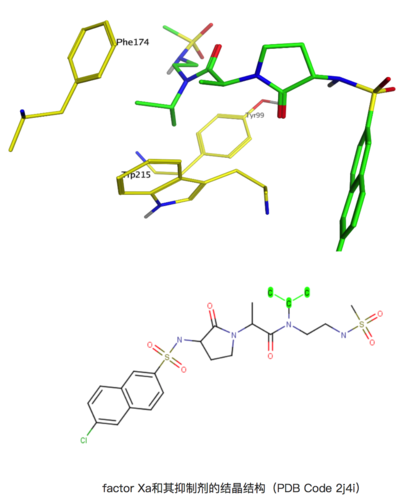
factor Xa和其抑制劑的結(jié)晶結(jié)構(gòu)(PDB Code 2j4i)
上圖是factor Xa和其抑制劑(From GSK)的結(jié)晶結(jié)構(gòu)(PDB Code 2j4i),其Ki是1nM,但是如果將圖示中高亮出的異丙基替換成氫(H),其活性直接下降到39μM,活性直接相差了4萬倍!
上圖例子中可以看到,Tyr99、Trp215和Phe174組成的疏水性的結(jié)合空腔,通過配體上的異丙基形成疏水相互作用,從而提高活性。但是這一次,不提則已,一提就是驚人的4萬倍!這是為什么呢?
要說清楚這個問題,就得請出今天的二號主角,也是大家在藥物設(shè)計中容易忽略的,去溶劑化效應(yīng)(desolvation)。
如下圖清晰的描述了該過程,藥物分子在水溶液環(huán)境里進入靶標(biāo)蛋白結(jié)合空腔的過程中,需要脫離原來的水環(huán)境,并且將靶標(biāo)結(jié)合口袋中的水排出,這個過程中耗散或獲得的能量就是去溶劑化能。
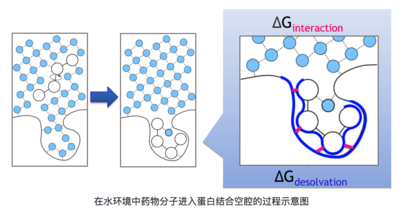
在水環(huán)境中藥物分子進入蛋白結(jié)合空腔的過程示意圖
回到factor Xa的例子,我們在3D結(jié)構(gòu)中看一下結(jié)合口袋的位置(下圖),很明顯,結(jié)合口袋并未深入蛋白質(zhì)內(nèi)部,而是在靠近溶劑可及的表面。假設(shè)沒有疏水性的異丙基占據(jù),疏水性空腔位置可能占據(jù)著一些水分子,同樣這些在疏水表面的水分子會更加的有序其狀態(tài)數(shù)會較少,從而對結(jié)合自由能有不利的貢獻;而通過異丙基能夠幫助排出這些水分子,從而獲得除了疏水相互作用外的一部分能量,所以活性被大大提升了[5,6]。從這個例子中我們可以看到,藥物設(shè)計中我們還需要考慮在無配體結(jié)合狀態(tài)下結(jié)合口袋可能的水化狀態(tài)!
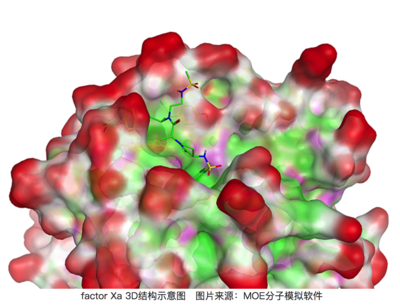
上圖可以看到2j4i中的配體結(jié)合口袋在靠近蛋白表面,處于溶劑容易進入的區(qū)域。紅色區(qū)域代表暴露溶劑中的區(qū)域,青色代表疏水區(qū)域,粉色代表極性基團區(qū)域。
值得注意的是,去溶劑化也有可能會導(dǎo)致看起來能夠很好地與受體結(jié)合的分子其實并不能很好地結(jié)合。比如在一個針對HIV-1蛋白酶抑制劑耐藥性的研究中發(fā)現(xiàn),因為突變導(dǎo)致結(jié)合口袋的去溶劑化能顯著提高,從而導(dǎo)致了耐藥性[7]。
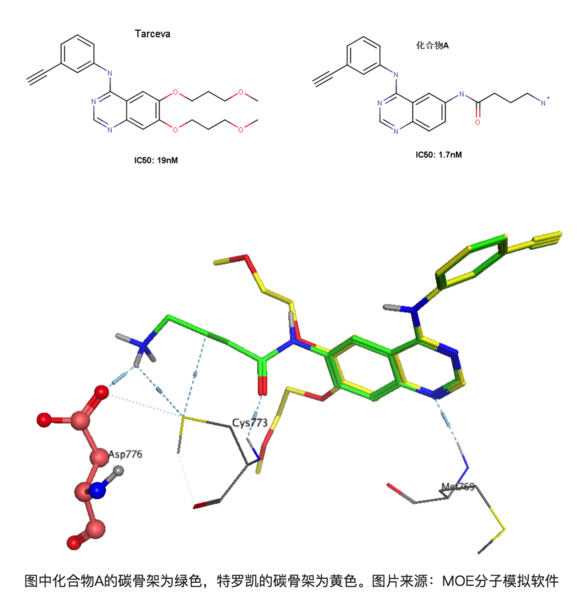
再比如在有喹唑啉母環(huán)的化合物是一類重要的EGFR(epidermal growth factor receptor,表皮生成因子受體)抑制劑,易瑞沙和特羅凱都屬于該類藥物。比如下圖的兩個化合物,左圖為著名藥物特羅凱,右圖為發(fā)現(xiàn)的另外一個同系的EGFR抑制劑(暫且稱為化合物A)[8]。右圖化合物A能與EGFR 的Asp776形成離子鍵,大家知道離子鍵能達到的鍵能是極強的,理論上,與特羅凱相比,化合物A的活性提升應(yīng)該遠不止10倍。
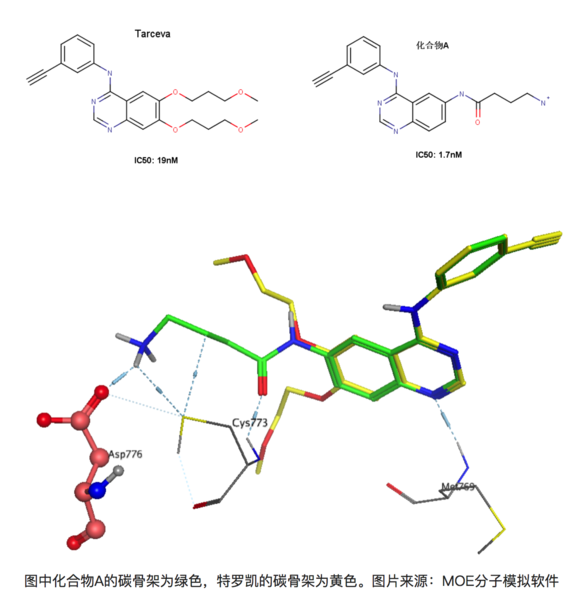
上圖為化合物A和特羅凱的疊合結(jié)果,可以看到化合物A能和Asp776形成鍵能較強的離子鍵,但是活性卻只提升了10倍!其實這正是由于去溶劑化能的影響,Asp776位于溶劑可及的蛋白表面上,容易與水形成較為穩(wěn)定的氫鍵,因此要與-NH3+作用時必須脫離與某些水分子的作用而耗費一定的能量。同理,化合物A上的-NH3+也是一樣的,需要斷開一部分與水形成的氫鍵在于Asp776的羧基相互作用。因此看似形成很強的氫鍵,但是由于去溶劑化的作用,其活性的提升未必有想象中的理想。

隨著電子產(chǎn)品防水需求的不斷提高,從原先的 IP54到現(xiàn)在的IP67IP68等級!市場上出現(xiàn)了防水透氣膜和防水透音膜,目前這兩種不同的材料應(yīng)用被搞混了,今天便與大家一起討論防水透氣
最近各地降雨量激增,所以手機就難免會沾點水,作為生活中不可或缺的電子產(chǎn)品,防水已經(jīng)成為一個十分重要重要功能,而且個人對目前的IP68手機市場是相當(dāng)不滿意的。為什么?太貴
自然界中荷葉具有出淤泥而不染的典型不沾水特性(學(xué)術(shù)上稱為Cassie-Baxter狀態(tài)),具有自清潔、抗結(jié)冰、減阻、抗腐蝕等廣泛應(yīng)用價值,而玫瑰花瓣則具有水滴高粘附特性(稱為Wenze

派瑞林各種粉材真空鍍膜技術(shù)加工 納米涂層防水處理
派瑞林各種粉材真空鍍膜技術(shù)加工 納米涂層防水處理

高阻隔強絕緣防汗液涂層藍牙耳機3C電子產(chǎn)品IPX7納米材料
高阻隔強絕緣防汗液涂層藍牙耳機3C電子產(chǎn)品IPX7納米材料

耐磨超疏水納米材料 絕緣子架空導(dǎo)線電纜橋梁防覆冰涂層
耐磨超疏水納米材料 絕緣子架空導(dǎo)線電纜橋梁防覆冰涂層

真空等離子氣相沉積技術(shù)納米防水鍍膜加工 產(chǎn)能5萬片天
真空等離子氣相沉積技術(shù)納米防水鍍膜加工 產(chǎn)能5萬片天
親水疏油自潔凈納米涂層 易去污 無機防紫外高硬度材料
親水疏油自潔凈納米涂層 易去污 無機防紫外高硬度材料

臺灣超親水防霧塑料專用 附著力好 透過率高 持久有效
臺灣超親水防霧塑料專用 附著力好 透過率高 持久有效

